CÁC NGUYÊN TẮC SƯ PHẠM VÀ PHƯƠNG PHÁP DẠY HỌC CHỦ YẾU ĐƯỢC SỬ DỤNG TRONG GIẢNG DẠY CHẤT HỮU CƠ - PHẦN: HYDROCARBON NO (Tiếp theo phần trước)
5. Tính chất hóa học
Ở điều kiện thường, các ankan kém hoạt động hóa học, chúng không phản ứng với kiềm đặc, axit đặc và các chất ô xi hóa như kali pecmanganat hay bicromat. Do liên kết C – H không phân cực cho nên sự phân cắt liên kết theo kiểu đồng ly. Vì vậy, phản ứng thế SR và phản ứng hủy là những phản ứng đặc trưng quan trọng nhất.
5.1. Phản ứng thế
Đây là phản ứng mà các H của ankan được thế dần bởi các tác nhân thế. Quan trọng hơn cả là phản ứng halogen hóa, phản ứng chỉ thực hiện được khi có ánh sáng hoặc ở nhiệt độ cao.
5.1.1. Phản ứng halogen hóa
Giai đoạn khơi mào phản ứng:
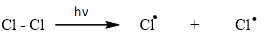
Giai đoạn phát triển mạch:
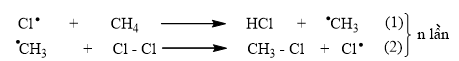
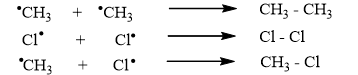
Giai đoạn tắt mạch:
Phản ứng sẽ thay thế dần các nguyên tử H trong CH4:
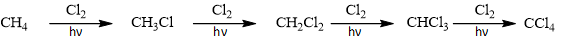
Tuy nhiên, ta không thể khống chế sản phẩm của phản ứng, và sẽ thu được hỗn hợp sản phẩm cho dù ta dùng CH4 nhiều hơn Cl2 rất nhiều.
Đối với các ankan có nhiều vị trí thế khác nhau, sản phẩm thế tạo thành sẽ ưu tiên thế vào vị trí H của C có bậc cao hơn. (xem lại phần 5.7.3.)
Khả năng phản ứng còn tùy thuộc vào các Halogen, nói chung, F2 phản ứng quá mạnh có thể gây hủy mạch, I2 phản ứng rất kém nên thường dùng Cl2 và Br2 để tiến hành phản ứng.
5.1.2. Phản ứng nitro hóa
Là phản ứng thế H của ankan bằng gốc *NO2. Phản ứng này cũng giống phản ứng halogen hóa về mặt cơ chế, tuy nhiên, gốc tự do *NO2 xuất hiện do nhiệt độ khoảng 4500C.
Phản ứng tiếp tục diễn ra như halogen hóa, phản ứng chung như sau:
(còn nữa)
Bài viết liên quan
- Học Cách "Tư Duy Thuật Toán": Kỹ Năng Sinh Tồn Của Sinh Viên Trước Làn Sóng Tự Động Hóa 2026
- Sao Hỏa: Bản Giao Hưởng Của Sắt, Carbon Và Những Bí Ẩn Hóa Học
- Toán học: "Ngôn ngữ" đằng sau linh hồn của máy móc
- Dẫn xuất Halogen: Từ Nền Tảng Hóa Học Đến Ứng Dụng Trong Công Nghệ Thực Phẩm
- CÔNG NGHỆ THỊT THỰC VẬT


